Pathophysiologie des Typ-2-Diabetes mellitus
Verwandte Artikel: Pathophysiologie des Typ-2-Diabetes mellitus
- Diabetes Mellitus: Eine Komplexe Krankheit Mit Weitreichenden Folgen
- Diabetes Mellitus: Symptome, Ursachen Und Behandlung
- Diabetes Mellitus Leitlinien 2023: Ein Umfassender Leitfaden Für Die Optimale Therapie
- Typ-2-Diabetes: Eine Komplexe Erkrankung Mit Vielfältigen Ursachen Und Folgen
- Diabetes Mellitus Typ 2 In Österreich: Eine Wachsende Herausforderung
Einführung
Mit Begeisterung werden wir uns durch das faszinierende Thema rund um Pathophysiologie des Typ-2-Diabetes mellitus vertiefen. Lassen Sie uns interessante Informationen zusammenfügen und den Lesern frische Perspektiven bieten.
Table of Content
- 1 Verwandte Artikel: Pathophysiologie des Typ-2-Diabetes mellitus
- 2 Einführung
- 3 Video über Pathophysiologie des Typ-2-Diabetes mellitus
- 4 Pathophysiologie des Typ-2-Diabetes mellitus
- 4.1 I. Ursachen und Risikofaktoren des Typ-2-Diabetes
- 4.2 II. Pathophysiologische Mechanismen des Typ-2-Diabetes
- 4.3 III. Komplikationen des Typ-2-Diabetes
- 4.4 IV. Die Rolle des Insulins im Glukose-Stoffwechsel
- 4.5 V. Pathogene Mechanismen der Insulinresistenz
- 4.6 VI. Schlussfolgerung
- 5 Abschluss
Video über Pathophysiologie des Typ-2-Diabetes mellitus
Pathophysiologie des Typ-2-Diabetes mellitus
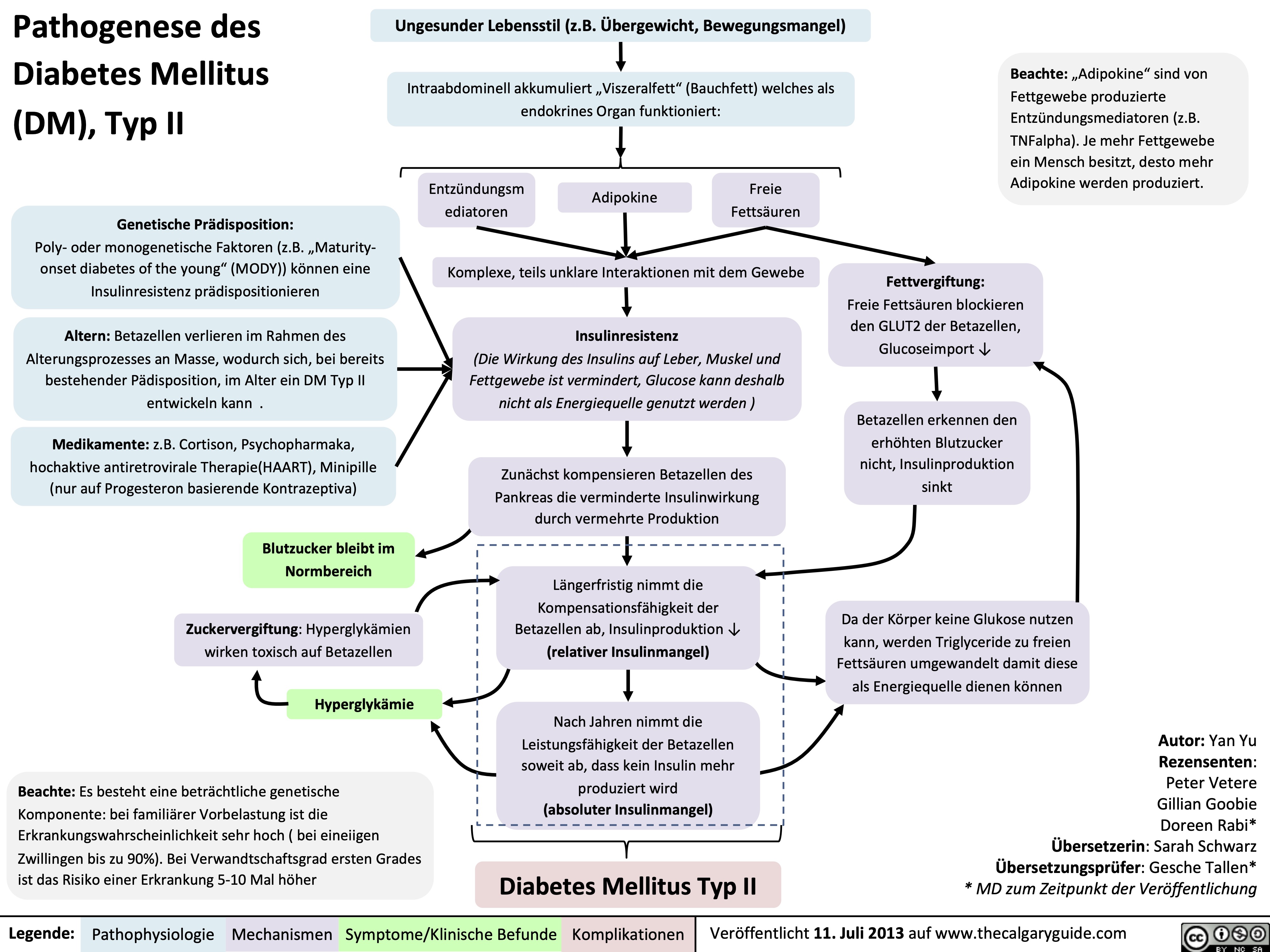
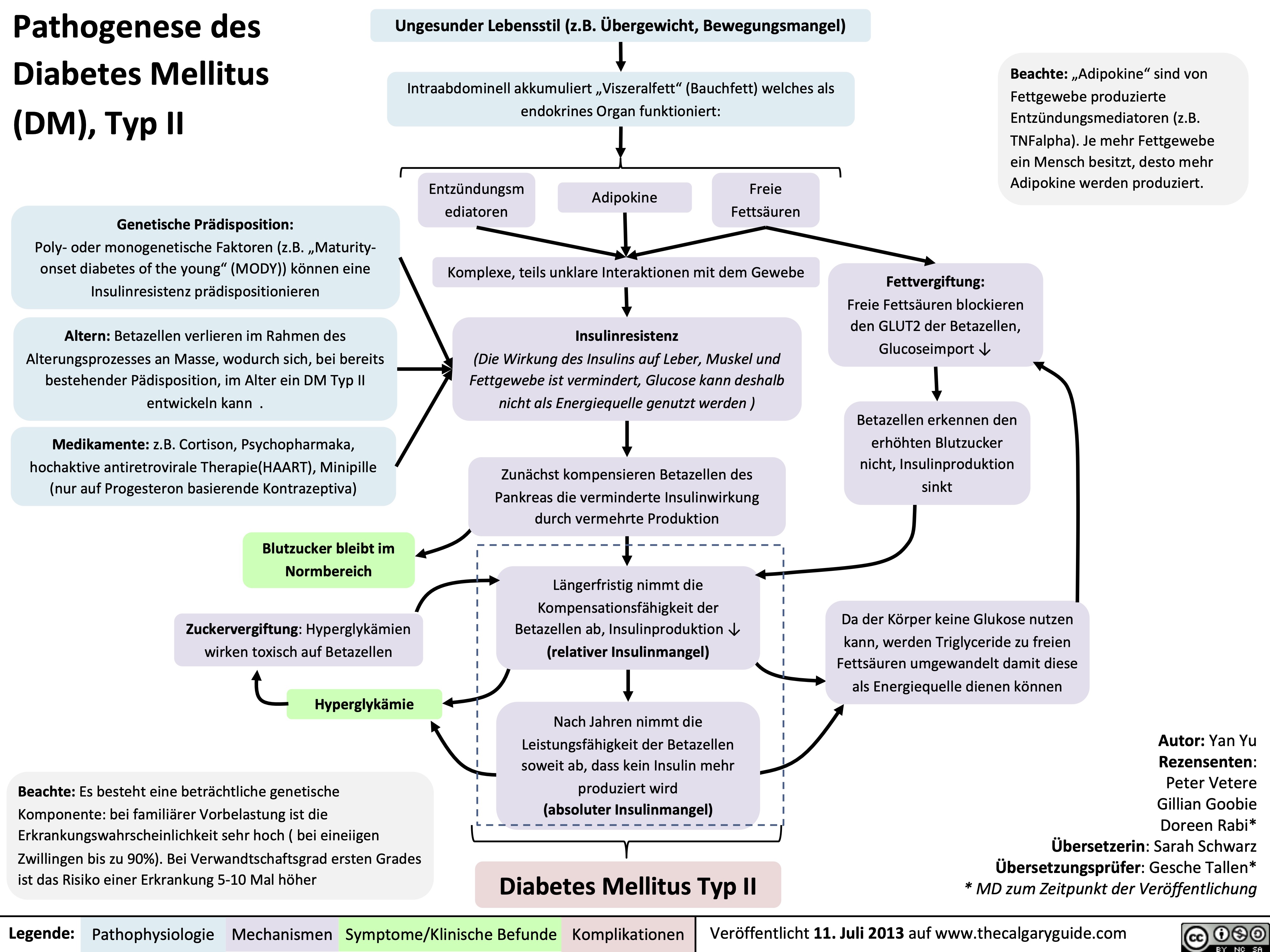
Der Typ-2-Diabetes mellitus (T2DM) ist eine chronische Stoffwechselerkrankung, die durch eine Kombination aus genetischer Prädisposition und Umweltfaktoren ausgelöst wird. Im Zentrum der Erkrankung steht eine Insulinresistenz, d.h. die Zellen des Körpers reagieren nicht mehr ausreichend auf das Hormon Insulin, welches für die Regulierung des Blutzuckerspiegels verantwortlich ist. Dies führt zu einer Hyperglykämie, also einem erhöhten Blutzuckerspiegel, der langfristig zu schweren Komplikationen in verschiedenen Organen führen kann.
I. Ursachen und Risikofaktoren des Typ-2-Diabetes
Der Typ-2-Diabetes entwickelt sich meist schleichend über einen längeren Zeitraum, wobei genetische und Umweltfaktoren zusammenspielen.
1. Genetische Prädisposition:
- Familiäre Häufung: Das Risiko, an Typ-2-Diabetes zu erkranken, ist bei Menschen mit Familienangehörigen, die ebenfalls an der Krankheit leiden, deutlich erhöht.
- Genetische Variationen: Mehrere Gene wurden mit einem erhöhten Risiko für Typ-2-Diabetes in Verbindung gebracht. Diese Gene beeinflussen verschiedene Prozesse im Stoffwechsel, wie z.B. die Insulinsekretion, die Insulinempfindlichkeit und die Glukoseaufnahme.
2. Umweltfaktoren:
- Übergewicht und Fettleibigkeit: Übermäßiges Körpergewicht und insbesondere Bauchfett erhöhen das Risiko für Insulinresistenz.
- Bewegungsmangel: Ein sitzender Lebensstil führt zu einer verringerten Insulinempfindlichkeit und einer erhöhten Insulinresistenz.
- Ungesunde Ernährung: Eine Ernährung, die reich an gesättigten Fettsäuren, Zucker und verarbeiteten Lebensmitteln ist, fördert die Insulinresistenz und das Übergewicht.
- Alter: Das Risiko für Typ-2-Diabetes steigt mit zunehmendem Alter, da die Insulinempfindlichkeit im Laufe des Lebens tendenziell abnimmt.
- Ethnische Zugehörigkeit: Manche ethnische Gruppen haben ein höheres Risiko für Typ-2-Diabetes als andere, z.B. Menschen afrikanischer Abstammung, Südasiaten und Latinos.
- Andere Faktoren: Weitere Faktoren, die das Risiko für Typ-2-Diabetes erhöhen, sind z.B. Stress, Rauchen und bestimmte Medikamente.

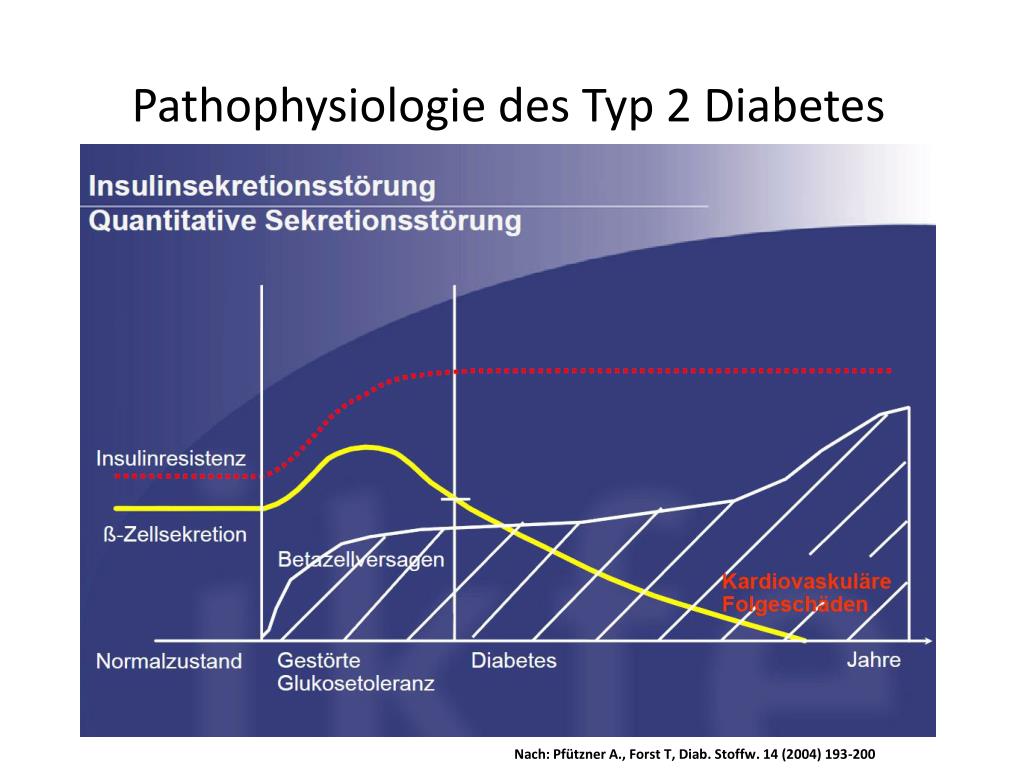
II. Pathophysiologische Mechanismen des Typ-2-Diabetes
Die Entwicklung des Typ-2-Diabetes ist ein komplexer Prozess, der mehrere Veränderungen im Stoffwechsel beinhaltet:
1. Insulinresistenz:

- Zelluläre Insulinresistenz: Der Grund für die Insulinresistenz liegt in der gestörten Signaltransduktion des Insulins in den Zielzellen.
- Reduzierte Glukoseaufnahme: Insulinresistenz führt dazu, dass die Zellen weniger Glukose aus dem Blut aufnehmen können, wodurch der Blutzuckerspiegel ansteigt.
- Zunehmende Lipolyse: Insulinresistenz führt zu einer verstärkten Freisetzung von Fettsäuren aus dem Fettgewebe. Diese Fettsäuren gelangen in die Leber und tragen zur Entstehung von Neufettbildung und zur Insulinresistenz in anderen Geweben bei.
2. Kompensatorische Hyperinsulinämie:
- Zunehmende Insulinproduktion: Um den Blutzuckerspiegel trotz Insulinresistenz zu regulieren, versucht der Körper, mehr Insulin zu produzieren.
- Erschöpfung der Betazellen: Die ständigen Anstrengungen der Betazellen in der Bauchspeicheldrüse, mehr Insulin zu produzieren, können zu einer Erschöpfung der Zellen führen, was sich in einer reduzierten Insulinsekretion niederschlägt.
3. Störung des Glukose-Stoffwechsels:
- Erhöhte Glukoseproduktion in der Leber: In der Leber wird die Glukoseproduktion durch den Zustand der Insulinresistenz gesteigert. Dies trägt zum erhöhten Blutzuckerspiegel bei.
- Reduzierte Glukoseaufnahme in der Muskulatur: Durch die Insulinresistenz wird die Glukoseaufnahme in der Muskulatur vermindert. Dies führt zu einem Mangel an Energie in den Muskelzellen.
- Erhöhte Lipolyse im Fettgewebe: Die Insulinresistenz führt zu einer verstärkten Freisetzung von Fettsäuren aus dem Fettgewebe, die dann in die Leber wandern und zur Neufettbildung und zur Verstärkung der Insulinresistenz beitragen.
4. Entwicklung der chronischen Hyperglykämie:
- Langfristiger erhöhter Blutzuckerspiegel: Im Verlauf der Erkrankung verringert sich die Insulinsekretion immer weiter, wodurch der Blutzuckerspiegel chronisch erhöht bleibt.
- Glykierung von Proteinen: Der erhöhte Blutzuckerspiegel führt zu einer chemischen Verbindung von Zuckermolekülen mit Proteinen. Dieser Prozess, die Glykierung, führt zu einer Veränderung der Eigenschaften der Proteine und kann zu einem abnormalen Funktionieren verschiedener Organe führen.
III. Komplikationen des Typ-2-Diabetes
Die chronische Hyperglykämie im Rahmen des Typ-2-Diabetes führt zu einer Reihe von Langzeitkomplikationen, die verschiedene Organe betreffen können.
1. Mikrovaskuläre Komplikationen:
- Diabetische Retinopathie: Schädigung der Blutgefäße in der Netzhaut des Auges führt zu Sehstörungen und schließlich zur Blindheit.
- Diabetische Nephropathie: Schädigung der Blutgefäße in den Nieren führt zu einer eingeschränkten Nierenfunktion und kann schließlich zur chronischen Niereninsuffizienz führen.
- Diabetische Neuropathie: Schädigung der Blutgefäße in den Nerven führt zu verschiedenen neurologischen Symptomen wie Taubheit, Kribbeln, Muskelschwäche und Schmerzen.
2. Makrovaskuläre Komplikationen:
- Koronare Herzkrankheit: Verengung der Herzkranzgefäße führt zu Angina pectoris oder Herzinfarkt.
- Schlaganfall: Verstopfung oder Verengung der Blutgefäße im Hirn führt zu einem Schlaganfall.
- Periphere arterielle Verschlusskrankheit: Verengung der Blutgefäße in den Beinen und Armen führt zu Schmerzen, Taubheit und schließlich zu Gewebeschäden.
3. Andere Komplikationen:
- Fußgeschwüre: Durch die Nervenschäden führt die verminderte Wahrnehmung von Schmerzen zu einem erhöhten Risiko für Fußverletzungen und -geschwüre.
- Diabetisches Fußsyndrom: Eine Kombination aus Nervenschäden und durchblutungsstörungen führt zu Schmerzen, Taubheitsgefühlen und Schwierigkeiten beim Laufen.
- Diabetische Ketoazidose: Eine schwere Komplikation, die durch einen stark erhöhten Blutzuckerspiegel und einen Mangel an Insulin ausgelöst wird. Sie führt zu Übelkeit, Erbrechen, Dehydration und Bewusstlosigkeit.
- Hyperglykämische Hyperosmolarität: Eine schwere Komplikation, die durch einen extrem hohen Blutzuckerspiegel ausgelöst wird und zu Bewusstlosigkeit, Dehydration und Koma führen kann.
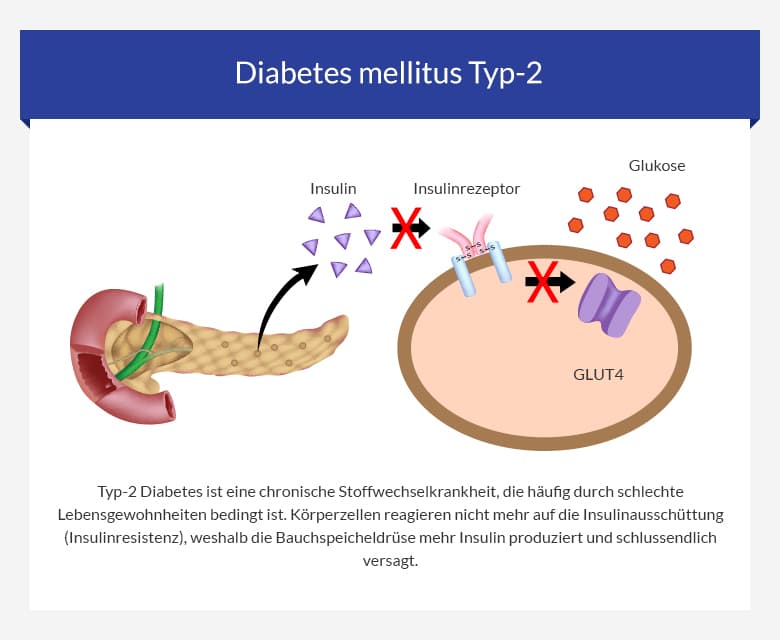
IV. Die Rolle des Insulins im Glukose-Stoffwechsel
Insulin, ein Hormon, das in der Bauchspeicheldrüse ( genauer gesagt in den β-Zellen der Langerhans’schen Inseln) produziert wird, spielt eine zentrale Rolle bei der Regulation des Blutzuckerspiegels.
1. Insulinwirkung auf verschiedene Gewebe:
- Leber: Insulin hemmt die Glukoseproduktion in der Leber und fördert die Speicherung von Glukose in Form von Glykogen.
- Muskel: Insulin fördert die Glukoseaufnahme in die Muskelzellen und die Speicherung von Glukose in Form von Glykogen.
- Fettgewebe: Insulin fördert die Glukoseaufnahme in die Fettzellen und die Speicherung von Fett.
- Andere Gewebe: Insulin wirkt auch auf andere Gewebe, z. B. auf die Nieren, das Gehirn und das Herz.
2. Insulinrezeptor und Signalkaskade:
- Insulinrezeptor: Insulin bindet an seinen Rezeptor auf der Zelloberfläche.
- Signalkaskade: Die Bindung von Insulin an seinen Rezeptor führt zu einer Kette von biochemischen Reaktionen, die die Glukoseaufnahme in die Zellen fördern.
3. Insulinresistenz und die gestörte Signaltransduktion:
- Störung der Insulinsignalkaskade: Bei Insulinresistenz ist die Signaltransduktion des Insulins in den Zielzellen gestört.
- Reduzierte Glukoseaufnahme: Die gestörte Signaltransduktion führt zu einer verminderten Glukoseaufnahme in die Zellen.
- Erhöhte Glukoseproduktion in der Leber: Die Insulinresistenz führt zu einer erhöhten Glukoseproduktion in der Leber.
V. Pathogene Mechanismen der Insulinresistenz
Die Insulinresistenz im Rahmen des Typ-2-Diabetes ist ein komplexer Prozess, der durch verschiedene Faktoren beeinflusst wird.
1. Überaktivierung der Serin/Threonin-Kinasen:
- Erhöhung der Phosphorylierung: Im Zustand der Insulinresistenz werden Serin/Threonin-Kinasen überaktiviert, was zu einer erhöhten Phosphorylierung von Proteinen in der Insulinsignalkaskade führt.
- Störung der Signaltransduktion: Die Phosphorylierung von Proteinen der Insulinsignalkaskade führt zu einer Störung der Signaltransduktion und somit zu einer verminderten Glukoseaufnahme.
- Verstärkung der Insulinresistenz: Die überaktivierte Phosphorylierung von Proteinen verstärkt die Insulinresistenz.
2. Entzündung und Insulinresistenz:
- Chronische Entzündung: Chronische Entzündungen spielen eine wichtige Rolle bei der Entwicklung der Insulinresistenz.
- Zytokine und Insulinresistenz: Entzündungsmediatoren, wie z. B. Zytokine, tragen zur Insulinresistenz bei, indem sie die Signaltransduktion des Insulins stören.
- Übergewicht und chronische Entzündung: Übergewicht ist mit chronischen Entzündungen verbunden, die zum Entstehen der Insulinresistenz beitragen.
3. Lipid-Stoffwechselstörung und Insulinresistenz:
- Erhöhte Fettsäuren: Erhöhte Fettsäurekonzentrationen führen zu einer Störung der Insulinsignalkaskade und verstärken die Insulinresistenz.
- Lipotoxizität: Eine übermäßige Anhäufung von Fettstoffen in den Zellen (Lipotoxizität) führt zu einer Störung der Insulinsignalkaskade und verstärkt die Insulinresistenz.
- Bauchfett und Insulinresistenz: Bauchfett ist ein besonders gefährlicher Fetttyp, der mit einer erhöhten Insulinresistenz verbunden ist.
4. Genetische Faktoren und Insulinresistenz:
- Vererbung: Die Anfälligkeit für Insulinresistenz kann genetisch bedingt sein.
- Mutationen in Genen: Mutationen in Genen der Insulinsignalkaskade können zu einer gehemmten Signaltransduktion führen.
- Polymorphismen: Polymorphismen in Genen, die mit dem Stoffwechsel in Verbindung stehen, können die Wahrscheinlichkeit für die Entwicklung von Insulinresistenz erhöhen.
VI. Schlussfolgerung
Der Typ-2-Diabetes ist eine komplexe Stoffwechselerkrankung, die durch eine Kombination aus genetischer Prädisposition und Umweltfaktoren ausgelöst wird. Insulinresistenz, die durch eine Störung der Signaltransduktion des Insulins in den Zielzellen entsteht, ist ein zentrales Merkmal der Krankheit. Chronische Entzündungen, Lipotoxizität und genetische Faktoren spielen ebenfalls eine wichtige Rolle bei der Entwicklung der Insulinresistenz. Die durch die Insulinresistenz bedingte Hyperglykämie führt langfristig zu einer
breite Palette von Komplikationen, die verschiedene Organe betreffen können. Daher ist die frühzeitige Diagnose und Behandlung des Typ-2-Diabetes von entscheidender Bedeutung, um schwere Folgen zu vermeiden.
Abschluss
Daher hoffen wir, dass dieser Artikel wertvolle Einblicke in Pathophysiologie des Typ-2-Diabetes mellitus bietet. Wir danken Ihnen, dass Sie sich die Zeit genommen haben, diesen Artikel zu lesen. Bis zum nächsten Artikel!
Originally posted 2024-08-08 13:56:00.

Leave a Reply